水の中のイオンと導電率
1-4 水の中のイオンと導電率

オームの法則、導電率と一般的な話を進めてきましたが、概念が理解できたでしょうか。
理解できたが、水の導電率を測るということに何の意味があるのか?という最初からの疑問はなんら解決していないとお考えでしょう。ですから、そろそろ本題に入っていくことにします。
今までの話の中では電気は電流を流れていました。これは電線のような金属の中には自由電子というものがたくさんいて、それらがちょうどバケツリレーをして電気を運んでいると考えて下さい。(こういうものを電子伝導体と呼ぶ)
これに対し、電解質溶液のようにイオンが電気の伝導に与るものがこれから取り扱うものです。(イオン伝導体と呼ぶ)
ここでいきなり聞き慣れない言葉がいくつかでてきましたので説明しますと、ある物質を液体(Twinでは水)に溶かしたとき、得られた液が電気を流せる性質の場合、その液を電解質溶液といい、溶かした物質を電解質といいます。そして、溶液中で電気を運ぶ粒子をイオン(ギリシャ語で放浪者を意味する)と呼んでます。
身近なものでは食塩(Nacl)が電解質で、これを水に溶かして塩水を作るとナトリウムイオン(Na+)と塩化物イオン(Cl-)となり、それぞれが電気を運ぶ粒子ということです。
ここで先ほどの話を思い出して下さい。導電率とは、電気の流れやすさの指標でした。また、水の中ではイオンが電気を運びます。ということは、水の中でNa+,Cl-が多いほど電気は多く運ばれますから、導電率は大きくなるということです。
まとめてみますと、導電率を知ることで塩水の濃度を知ることができるということです。(Twin導電率計の塩分換算表示機能もこれを利用したものです。)
塩水の濃度と導電率 (液温25℃)
| NaCl濃度 (W / V) % | 導電率 (mS / cm) | NaCl濃度 (W / V) % | 導電率 (mS / cm) |
|---|---|---|---|
| 0.1 | 2.0 | 1.1 | 19.2 |
| 0.2 | 3.9 | 1.2 | 20.8 |
| 0.3 | 5.7 | 1.3 | 22.4 |
| 0.4 | 7.5 | 1.4 | 24.0 |
| 0.5 | 9.2 | 1.5 | 25.6 |
| 0.6 | 10.9 | 1.6 | 27.1 |
| 0.7 | 12.6 | 1.7 | 28.6 |
| 0.8 | 14.3 | 1.8 | 30.1 |
| 0.9 | 16.0 | 1.9 | 31.6 |
| 1.0 | 17.6 | 2.0 | 33.0 |
1-5 強電解質と弱電解質
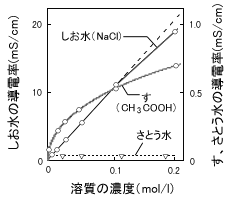
食塩水の導電率を知ることで濃度がわかるといいました。それじゃ砂糖水も測れる?と思われた方もいるんじゃないでしょうか。残念ながら導電率計では砂糖水の濃度は測れません。砂糖は水に溶けてもイオンにならない、つまり電解質ではないんです。水の中でイオンになって初めて導電率計で測ることができるのです。
さて、電解質も人間と同じでいろいろな性格のものがいます。電解質の分解のひとつに強電解質と弱電解質というのがあります。
これについて少しお話ししておきましょう。
強電解質
NaClやKClなど多くの塩類に見られるもので、水に溶けた電解質がほとんどイオンになり、濃度と導電率との関係はほぼ直線です。しかし、図でもわかるように低濃度領域に比べ高濃度になるほど濃度に対して導電率は大きくなっていません。これはラッシュ時に人込みを歩くのと同様に、濃度が高くなるほどイオンどうしが力を及ぼし合い、電気が流れにくくなっていると考えてください。
弱電解質
酢酸(す)等の有機酸にみられるもので、濃度が非常に低い領域では導電率と直線関係ですが、濃度が高くなるにつれイオン化する割合が減少し、高濃度では電解質のごく一部だけがイオン化し、そのほとんどは分子のままで水の中に溶けている様なものをいいます。


*mol/L:化学で物質の量を測る単位の1つにmol(モル)があります。これはアボガドロ数個(6.02×1023個)の粒子(原子、分子、イオン)の集まりを言います。ですからmol/Lという濃度の単位は溶液1l中に何molの物質が溶けているかをあらわします。

導電率の歴史
1745年イタリアで生まれたヴォルタ(A. Volta)は、成長とともに頭角をあらわし、1799〜1800年にヴォルタ電池を発明しました。それまで知られていた摩擦電池とは異なり、連続的な電流が得られるヴォルタ電池は世紀の大発見でした。このヴォルタの発明以来いろいろな人が新しい発見をしましたが、ドイツの物理学者オーム(G.Ohm)もその一人でした。オームは金属の導電率を測り、1827年有名なオームの法則を発見しました。
イギリスのファラディ(M. Faraday)は1791年鍛冶屋の子として生まれ、13歳のとき製本屋の見習工となりましたが、そこで多くの書籍に触れました。1813年、王立研究所の教授ディビーの助手となって化学と物理の分野で活躍し、1833年電気分解の法則を発見し、溶液中で電気を運ぶ粒子としてイオンを想定しました。
電解質溶液の電気伝導性は、ドイツのコールラウシュ(F.Kohlrausch)によって1869〜1880年にわたり、精力的に測定されました。コールラウシュはもともと、水のイオン積を求める手法として導電率を測り始めたと言われています。
このとき導電率を測定するために考案された「コールラウシュブリッジ」は、現在でもよく知られています。

| ヴォルタ | (A. Volta) | 伊 | 1745-1827 |
|---|---|---|---|
| オーム | (G. Ohm) | 独 | 1787-1854 |
| ファラディ | (M. Faraday) | 英 | 1791-1867 |
| コールラウシュ | (F. Kohlrausch) | 独 | 1840-1910 |
次ページ 法規と導電率計