酸性・アルカリ性の概念
前章の「やさしいpHの話」では、私たちの身近なところで見られるpHに関連した事項を中心に解説しました。
この章「pH測定の基礎」では、ガラス電極pH計を用いる場合の基礎的な事項および実際のpH測定に付随する事項について、必要な専門用語の意味を含めて解説します。専門用語は必要不可欠なものに限定していますので、以下の各項目についてお付き合いください。
水素イオン濃度

水溶液の酸性、アルカリ性は何によって決まるのでしょうか。
実は、水溶液の酸性、アルカリ性は水素イオンの濃度、つまりその水溶液にどれだけの割合で水素イオンが含まれているかによって決まるのです。
ここでは普通の水を例にとって考えてみましょう。
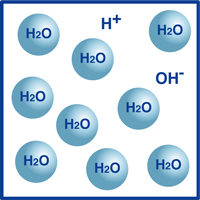
ご存じのように、水はH2Oという分子式であらわされますが、実際にもそのほとんどがH2Oという非常に安定した分子の形で存在しています。
ところが、ごく一部ですが、水素イオンH+と水酸化物イオンOH-が分かれた形で存在しています。
つまり右図のようになっています。
実は、この水素イオンと水酸化物イオンとのバランスがpHを決定する要素なのです。
水素イオンの方が多い場合は酸性、水酸化物イオンの方が多い場合はアルカリ性になります。
温度が一定であれば、どのような水溶液でも常に水素イオン濃度[H+]と水酸化物イオン濃度[OH-]との間に次の関係が見られます。
[H+][OH-]=Kw=10-14(=一定) (水の温度が25℃の場合)
Kwは「水のイオン積」あるいは「水の解離定数」と呼ばれます。
純水または中性溶液においては、
[H+]=[OH-]
であるから
[H+]=[OH-]=√(Kw)=√10-14=10-7
(√=ルート)
[H+]あるいは[OH-]のどちらか一方の値を知れば、他方の値もわかります。
そこで、実際には[H+]だけを測定し、これをpHの目安としています。pHが水素イオン濃度によって決まるというのは、以上のようなことからなのです。

pHは次の式で定義されています。
pH=-log10[H+]
私たちが接する水溶液の水素イオン濃度は、時に1リットル中に1モルぐらいのこともあれば、0.000001モルぐらいのこともあります。しかし、特にpH測定が必要な水素イオン濃度が非常に低い水溶液の場合は、小数点以下が非常に多く、数学的に取り扱いが不便です。デンマークの化学者であるSφrensen(セーレンセン)は、水素イオン濃度の逆数を常用対数で示したものをpHと定めることを提案しました。すなわち
pH=-log10[H+]
中性の溶液の場合では、
[H+]=10-7
であるため、pHは7 になります。
以上からわかるように、たとえばpH4とは、水溶液中の水素イオン濃度が10-4mol/L、つまり水溶液1リットル中に0.0001モルの水素イオンが含まれているのです。
同じように、pH5は10-5mol/L、pH6は10-6mol/L、またpH7は10-7mol/Lの水素イオンが含まれています。ここで気がつくことは、pH4とpH7を比較して水素イオン濃度が1000倍も違うにもかかわらず、pHの表示では3単位の差として簡潔にあらわすことができます。このように、桁の変わる大きな数の変化を指数(べき数)であらわすことのメリットは、次の図からもわかります。
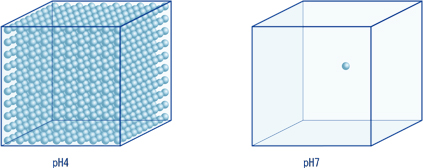
水素イオンが10-4mol/L(左)の場合と10-7mol/L(右)の場合、水素イオンの数は1000倍違いますが、pHの差では3とあらわすことができます(青い丸1個は、10-7mol/Lの水素イオンをあらわします)。
*mol/L:化学で物質の量を測る単位の1つにmol(モル)があります。これはアボガドロ数個(6.02×1023個)の粒子(原子、分子、イオン)の集まりを言います。mol/Lという濃度の単位は、溶液1リットル中に何モルの物質が溶けているかをあらわします。
次ページ 理論的なpHの定義