わんポイントレッスン<特別号②>
対談企画
「血液塗抹標本をつくる」
根尾 櫻子 先生 × 湯浅 宗一 先生

前回、血液塗抹標本の作製・観察について、人医療、動物医療のそれぞれの立場からお話しいただいたお二人。今回は根尾先生の勤務される麻布大学獣医学部にお邪魔し、実際に血液検体の塗抹標本を作製し、観察を実施しました。
対談者プロフィール

根尾櫻子麻布大学獣医学部獣医学科臨床診断学研究室講師
- 2001年 麻布大学獣医学部獣医学科卒業
- 2005年 麻布大学大学院獣医学研究科博士課程 (獣医学専攻)修了
- 2008年 University of Pennsylvania(Veterinary Clinical Pathology, Residency Program)修了
- 2008年 麻布大学獣医学部内科学第2研究室 助教
- 2010年 米国獣医病理学臨床病理専門医 {Diplomate ACVP (Clinical pathologist)}取得
- 2018年 麻布大学獣医学部臨床診断学研究室 講師
- 現在に至る

湯浅宗一株式会社堀場製作所医用事業本部学術顧問
- 1973年 京都府立医科大学附属病院 臨床検査部 入職
- 1995年 緒方富雄賞受賞
- 2000年 京都府立医科大学附属病院 臨床検査部 技師長
- 2000年 文部大臣表彰
- 2011年 京都府立医科大学附属病院 臨床検査部 退職
- 2012年 株式会社堀場製作所 医用事業本部学術顧問 就任
- 2012年 京都府立医科大学 先端検査機器開発講座 所属
- 2015年 瑞宝双光章受章
- 現在に至る
— 本日はよろしくお願いします。まずはウェッジ法での塗抹検体作製方法を確認しながら、前回のお話にも出た、人検体と動物検体(犬・猫)の引き比べを行います。
湯浅宗一先生(以下、湯浅): ウェッジ法では引きガラスを使いますが、実は専用のものがあり(図1)、これを使うと比較的安定してきれいに引けます。今日はこれを使って引いてみましょう。

図1 引きガラス用スライドガラス
湯浅: まず、スライドガラスの端などにスポイトなどで血液を1滴垂らします。そこから、引きガラス短辺の両端に血液を少しずつつけて(図2)、塗抹用スライドガラスに接触させ、短辺全体に均等に血液を行き渡らせ、すっと引き伸ばします(図3)。机の上にスライドガラスを置いて引く方が安定して、良い標本を作りやすいです。
根尾櫻子先生(以下、根尾): 私はスライドガラスの端に血液を垂らして、そこから直接引き伸ばすことが多いです。
湯浅: それでも問題はないですね。日本臨床衛生検査技師会(日臨技)の勧告法でもそのようになっています。ただ、血液量の調節が難しいので、注意が必要です。日臨技勧告法では滴下する血液量を5μLと指定しています(図4)。

図2 血液量の調整

図3 血液塗抹標本の引き伸ばし方
動画 実際の血液塗抹標本作成
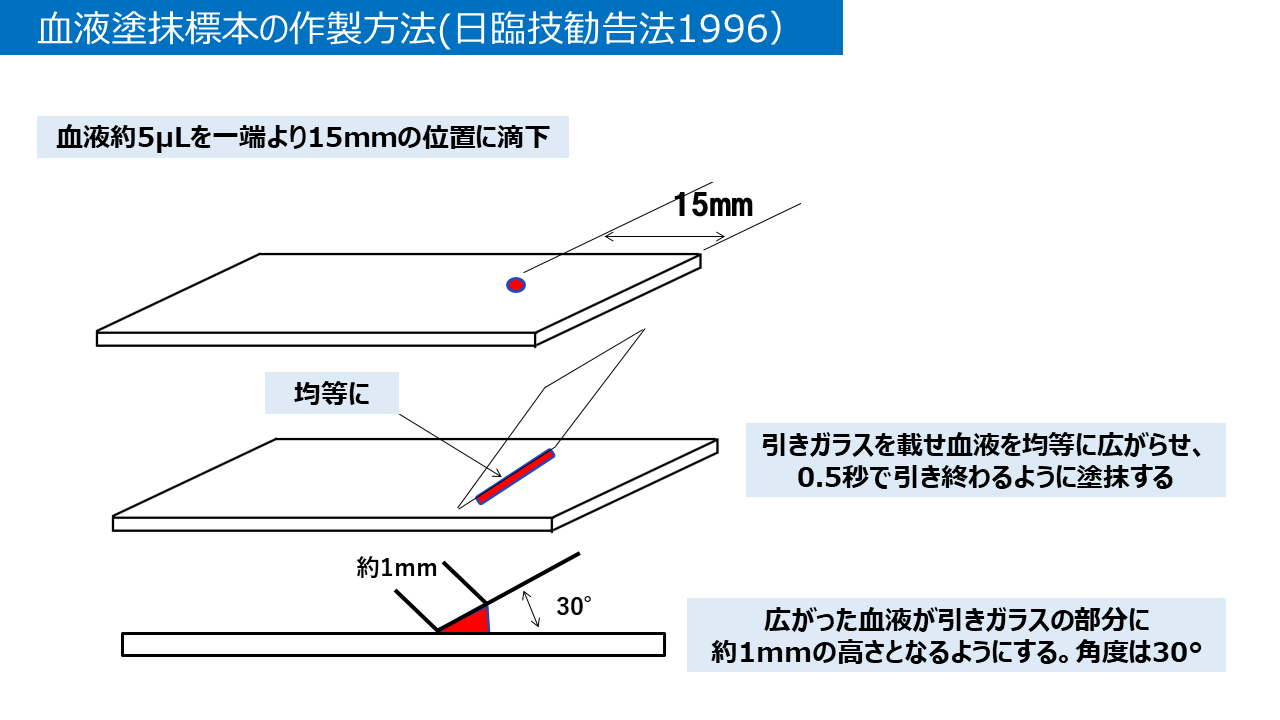
図4 血液塗抹標本の作製方法(日臨技勧告法)
— 同じ血液量を塗抹しているはずなのに、上手く引き終わらなかったり、逆に短すぎたりすることがあります。これはなぜでしょうか?
湯浅: 引きガラスを動かすスピードや角度の違いで、血液の層の厚さが変わります(図5)。引きガラスをゆっくり動かすと薄く、速く動かすと濃くなります。また、引きガラスを寝かせて引くと薄く、立てて引くと濃くなります。
根尾: これを知っていれば、多少血液量が多くなっても、角度やスピードを変えて引き終わりを調整できますね。
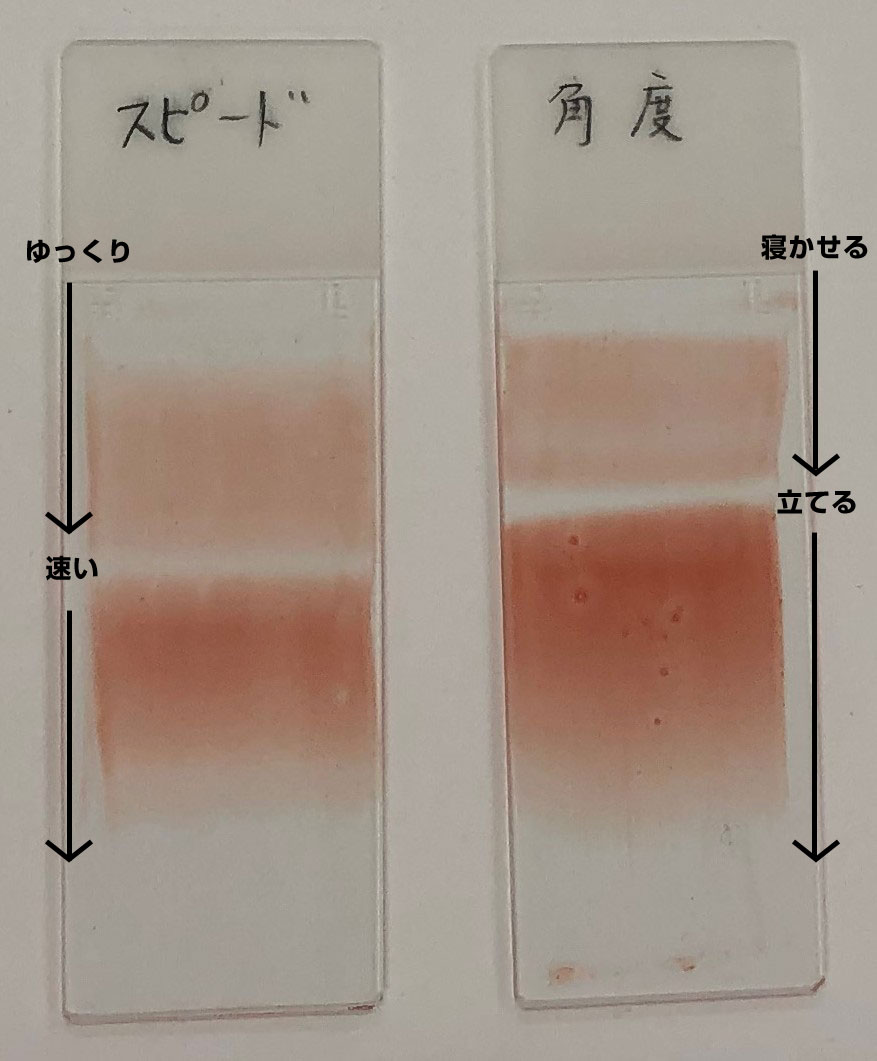
図5 スピード・引きガラスの角度の違いによる塗抹の変化
— 引き始めや引き終わりが円弧型になってしまうことがありますが、対策はありますか?
湯浅: 引きガラスと塗抹用ガラスの接地面で、血液をしっかり均等に行き渡らせることです。
根尾: 引きガラスを押し付けたり、接地面で動かしたりすると細胞がつぶれてしまうと習ったのですが、湯浅先生のやり方を見ていると血液を均等に行き渡らせるために左右に動かしていらっしゃいますよね。この動きは大丈夫なのですか?
湯浅: 大丈夫です。細胞は弾力がありますので、この操作で切れたりつぶれたりすることはありません。
— 今回は塗抹比較用に人検体と動物検体(犬・猫)を用意しました。引き比べてみていかがですか?
湯浅: 人・犬・猫で引いた感触に違いはないですね。犬検体や猫検体が人検体に比べて粘度が高くて引きにくいということもありません。
— では、犬・猫の標本を染色して観察します。染色は根尾先生が普段実施されているプロトコル(表1)を使用しました。
表1 麻布大学におけるライト・ギムザ染色プロトコル
| ライト液 | 3分 |
| リン酸バッファー(pH6.4) | 3分 |
| ギムザ液 | 12分 |
| 水洗→乾燥 |
| ライト液 | 3分 |
| リン酸バッファー(pH6.4) | 3分 |
| ギムザ液 | 12分 |
| 水洗→乾燥 |
根尾: 枚数が少ない時は、バットの上にスライドを並べて、スポイトで液を載せていきます。メタノール固定後、ライト液を重層し、3分後にさらにpH6.4のリン酸バッファーを重層します。
湯浅: ライト液にリン酸バッファーを重層する場合、液量を等量にすること、重層後にしっかり混和することが重要ですね(図6)。
根尾: はい。その後軽く水洗して、ギムザ液を同様にスポイトで垂らし、12分間染色し、水洗・乾燥させて完成です(図7)。

図6 バットを揺らしてライト液とリン酸バッファーをしっかりと混和する

図7 染色後のスライド
— それでは、低倍率で白血球数のカウントを見ていただきます。

図8 犬血液塗抹標本(400倍)
湯浅: まず、犬検体ですね。一視野で30個強の白血球が見えます(図8)。これぐらいの見え方だと白血球数は7000/μLぐらいではないでしょうか?
根尾: 自動血球計数装置LC-662での測定結果は、まさに7000/μLです(図9)。
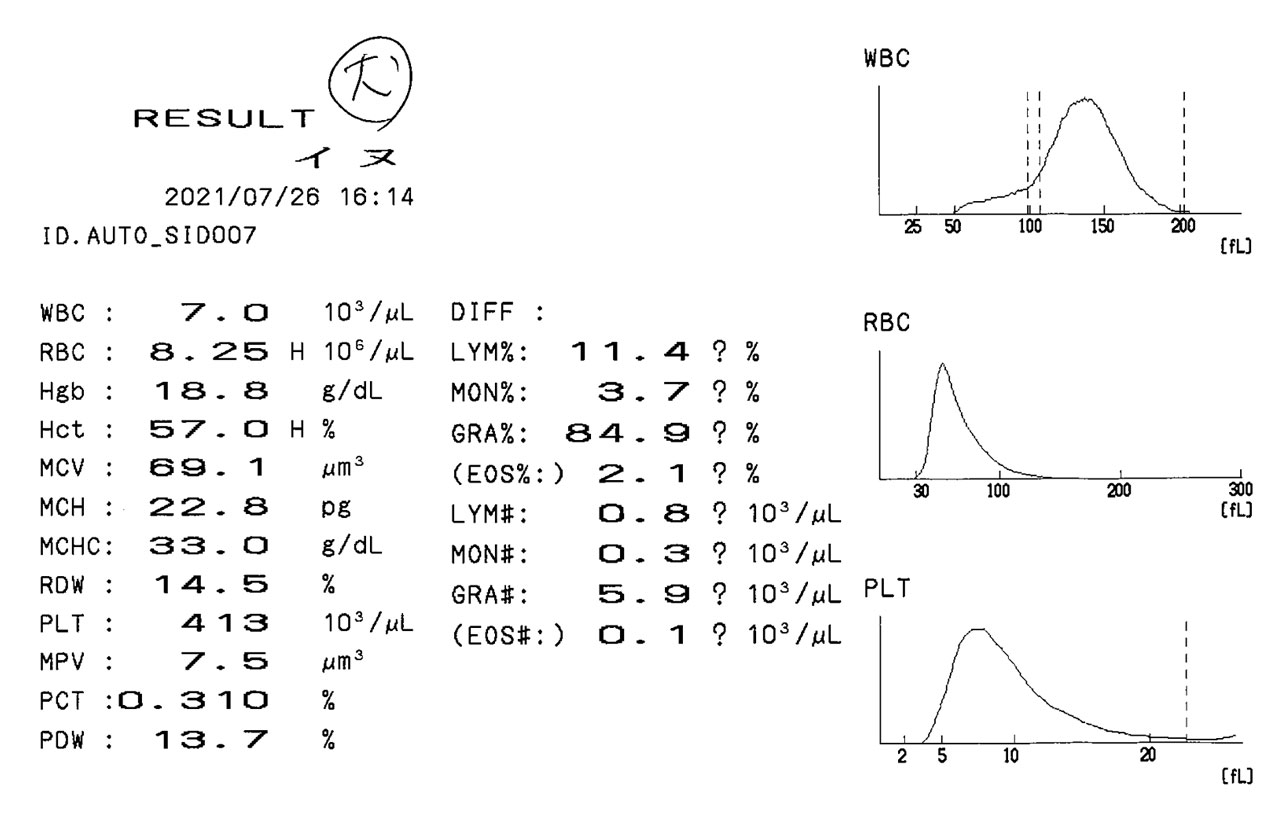
図9 LC-662測定結果(犬血液)
— 低倍率で確認することで、白血球の概数はある程度予測可能なのですね。では、猫検体はいかがでしょうか。
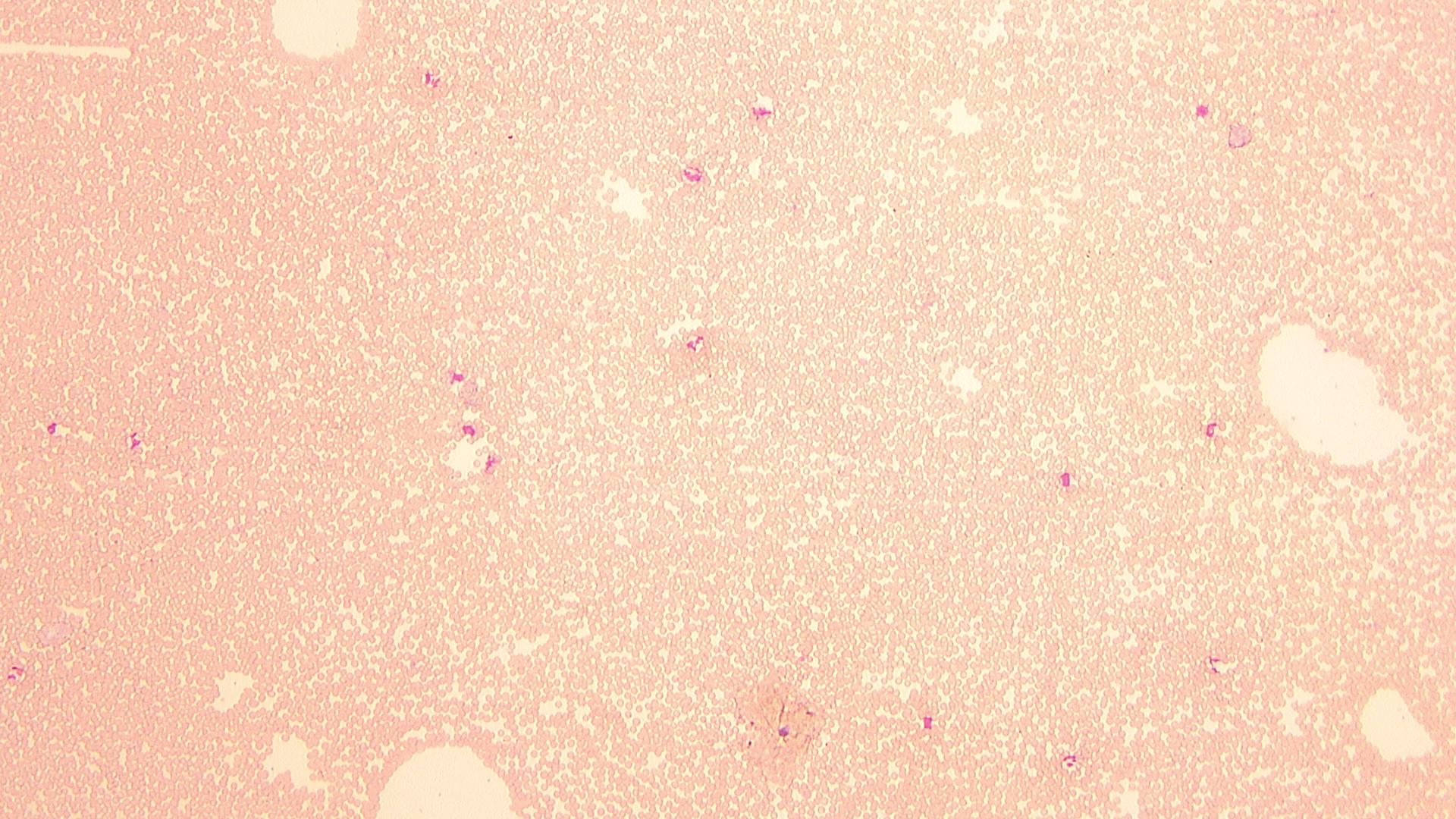
図10 猫血液塗抹標本(400倍)
湯浅: こちらも同じくらいか、少ないように見えます(図10)。6000-7000/μLといったところでしょうか。
根尾: こちらはLC-662の測定結果は、11000/μLです(図11)。なぜそんなに乖離したのでしょうか?

図11 LC-662測定結果(猫血液)
湯浅: ああ、わかりました。引き終わりの部分に白血球が多く集まってしまっています(図12)。引き終わり部分に集中していることを考慮すると、LC-662の11000/μLというのは妥当な数値です。
根尾: なるほど。確かに、犬検体の引き終わり(図13)に比べて、猫検体の引き終わり部分は白血球が密集していますね。ただこれは、猫検体が塗抹しにくいとか、猫検体だから起こったことではなく、たまたま今回は猫検体で起こってしまったということです。犬でもこんな風になるときはなりますね。

図12 猫血液塗抹標本(引き終わり部分)
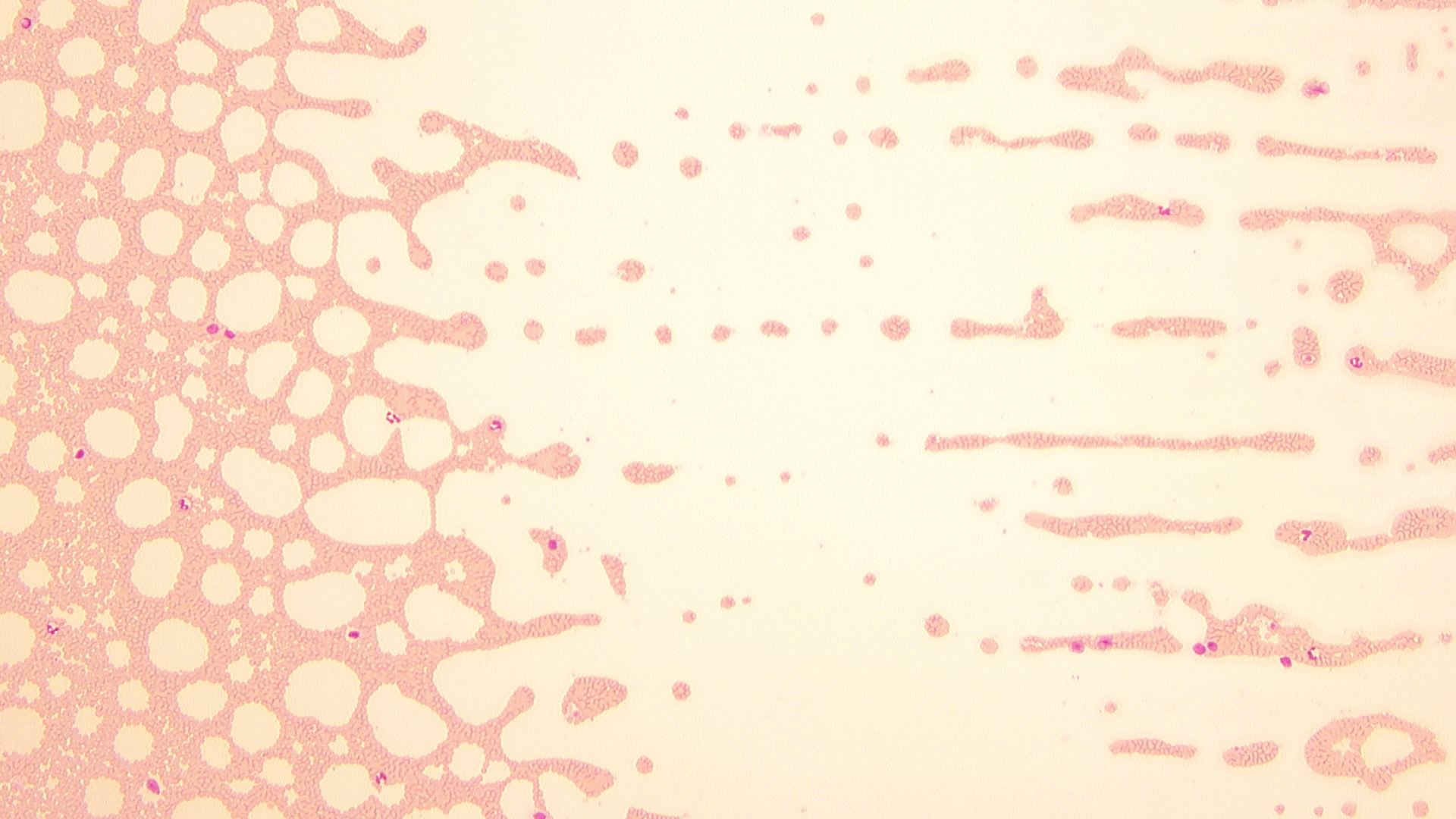
図13 犬血液塗抹標本(引き終わり部分)
湯浅: このように、標本の状態で観察結果に悪影響を生じることがあります。観察してみないと分からないことも多いので、標本は数枚作製する方がいいですね。
根尾: そうですね。
— 最後に、良い標本を作製するのに必要なことは何でしょうか。
湯浅: これまでお話ししたポイントを意識しながら、実際に何度も引いて練習することです。慣れてくると安定して良い塗抹を作製できるようになります。
根尾: 私も何度も練習しました。今日お聞きした中で、スピードや角度での違いなどはこれまであまり意識してこなかったのですが、意識することでより観察に適した標本を作れるようになりますね。

 HORIBA Medical for VET トップ
HORIBA Medical for VET トップ







 LC-662
LC-662

