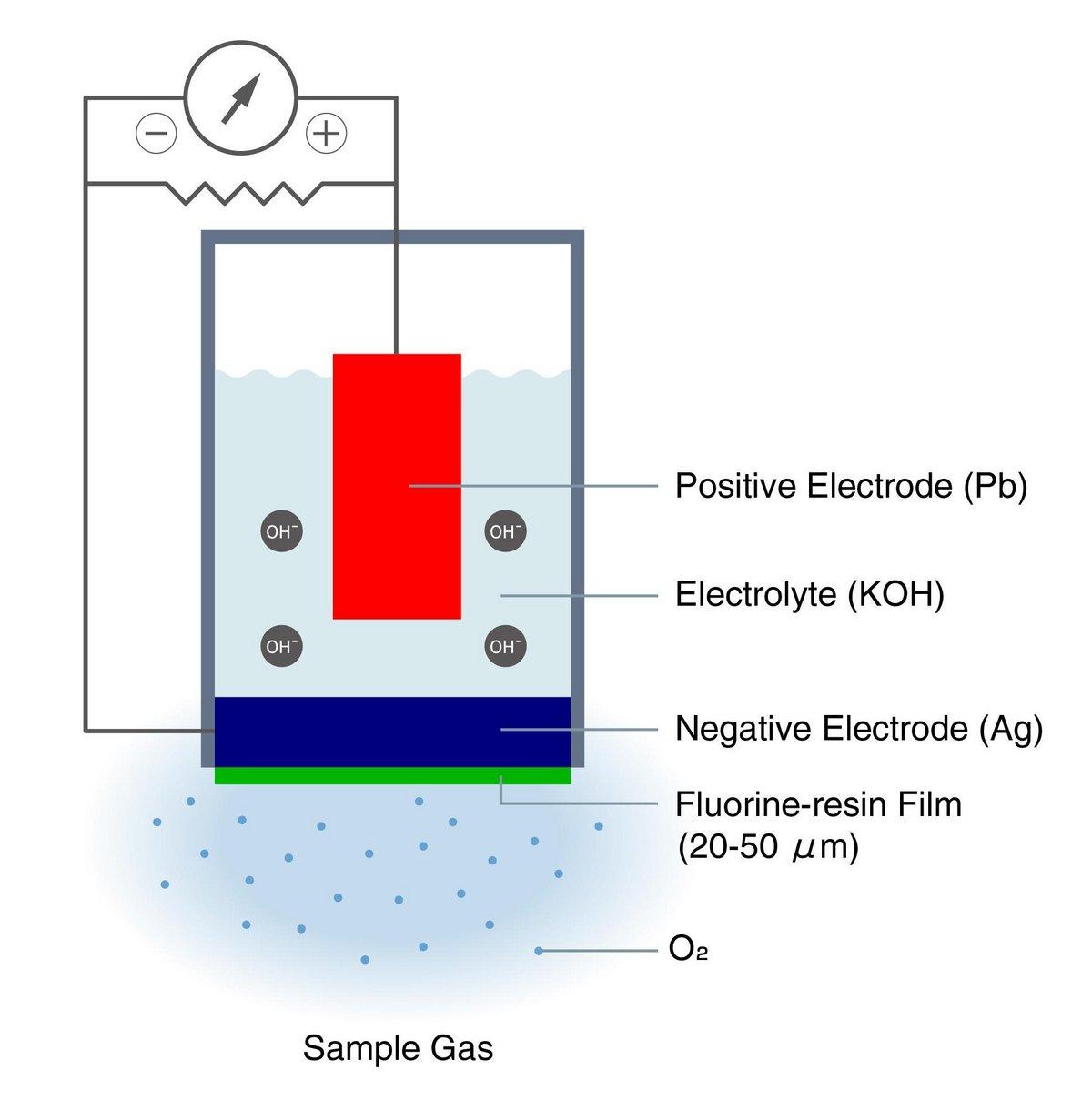
Abbildung 5: Aufbau und Funktionsprinzip der elektrochemischen Zellmethode des galvanischen Zelltyps eines Sauerstoffanalysators
Messprinzip, Aufbau und Funktionsweise (Bild 5)
Wenn ein in einem Elektrolyt lösliches Metall (unedles Metall als positive Elektrode der Zelle) und ein unlösliches Metall (Edelmetall als negative Elektrode der Zelle) in den Elektrolyten eingetaucht werden, löst sich das Metall an der positiven Elektrode auf und gibt Elektronen frei, die zur negativen Elektrode gelangen. An der negativen Elektrode nimmt der durch den dünnen Film gedrungene Sauerstoff Elektronen auf. (galvanische Zelle)
Reaktion an positiver und negativer Elektrode
Positive Elektrode
2Pb + 4OH- → 2PbO + 2H2O + 4e-
Negative Elektodade
O2 + 2H2O + 4e- → 4OH-
Da der Strom dieses Elektronenflusses proportional zum durch den Dünnfilm durchdrungenen Sauerstoff ist, kann die Sauerstoffkonzentration durch Messung dieses Stroms ermittelt werden.
Abbildung 5 zeigt einen typischen Sauerstoffanalysator vom Typ galvanische Zelle, der Kaliumhydroxid (KOH) als Elektrolyt, Blei (Pb) als positive Elektrode, Silber (Ag) als negative Elektrode und einen Fluorharzfilm als dünnen Film verwendet, der Sauerstoff durchlässt.