救急医療現場におけるpoint of care testing(POCT)の重要性
カリフォルニア大学デービス校
上田 悠先生

救急医療現場では様々な症例に遭遇しますが、緊急度が高いほど飼い主や主治医から十分な情報が得られないことが多いのが実情です 。そのような状況において、適切な治療や診断を迅速に行う為には、血液検査や画像診断が大きな役割を果たします。特に、重篤な傷病を呈した動物の診断と治療には、point of care testing (POCT)、すなわち「臨床現場即時検査」としてリアルタイムに検査結果を得る必要があります。本稿では、私が実際に診た症例を用いて、救急医療におけるPOCTの重要性を見ていきたいと思います。
7歳齢、避妊雌、体重4.5 kgのチワワミックスです。室内飼育で既往歴は特にありません。来院24時間前にペットホテルから帰宅後、元気食欲低下、下痢の症状が見られ、症状が悪化してきたことから当院の救急科に来院しました。約1か月前にも同じような下痢症状があったが、数日内に回復したとのことでした。
来院時の一般身体検査では、意識混濁が見られ、体温38℃、心拍数120 bpm、呼吸数16 bpm、BCS 3/9でした。可視粘膜はピンク色でCRTは2秒、大腿動脈圧は強く、四肢末梢の温感・冷感はありませんでした。また可視粘膜乾燥と皮膚弾力の低下が確認されました。体表リンパ節の腫脹及びその他の重大な異常は認められませんでした。
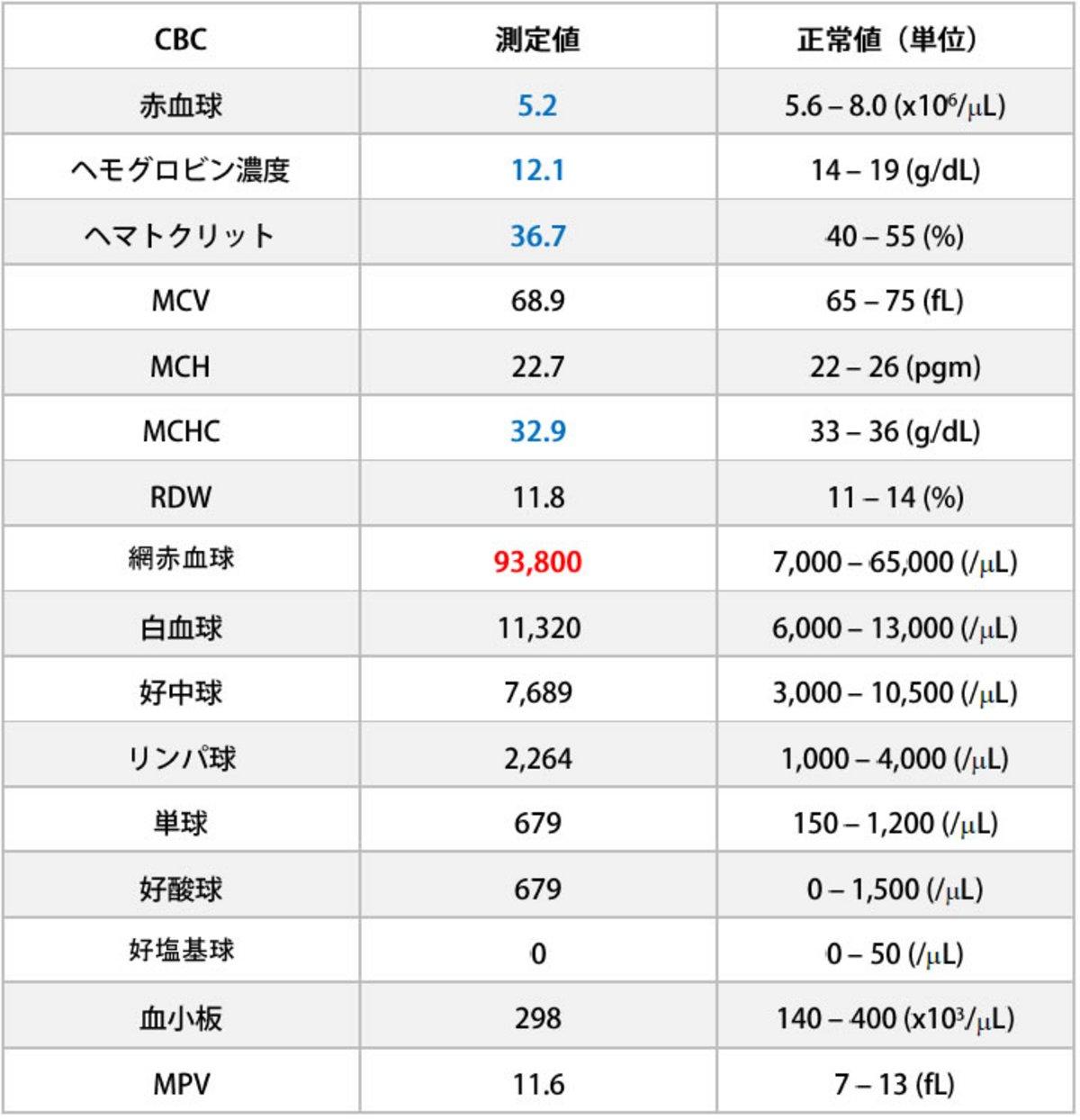
一般身体検査後、簡易測定器を用いて血糖値を測定したところ42 mg/dLでした。CBC検査では軽度の再生性貧血が認められました(表1)。血液生化学検査では、血糖値、アルブミン、コレステロール、マグネシウム濃度の低下が認められました(表2)。腹部超音波検査(AFAST: Abdominal Focused Assessment with Sonography for Trauma/Triage)においては、特に重大な所見は見受けられませんでした。
表1:来院時Complete blood count (CBC)検査結果
表2:来院時血液化学検査結果
一般身体検査と血糖値測定において意識混濁と低血糖症が診断されたことから、酸素供給下で静脈カテーテルを撓足皮静脈に設置、25%デキストロース(50%デキストロースを0.9%食塩水を用いて1:1に希釈)を4.5 mL(1 mL/kg)ボーラス投与しました。デキストロースのボーラス後、血糖値は105mg/dLでした。また一般身体検査結果において、脱水症状(5 ‒ 7%)があったことから2.5%糖加酢酸リンゲル液の持続点滴を50 mL/hの速度で開始しました 。1時間後に血糖値が198 mg/dLに上昇していたので、加糖量を1.5 % に減量しました。
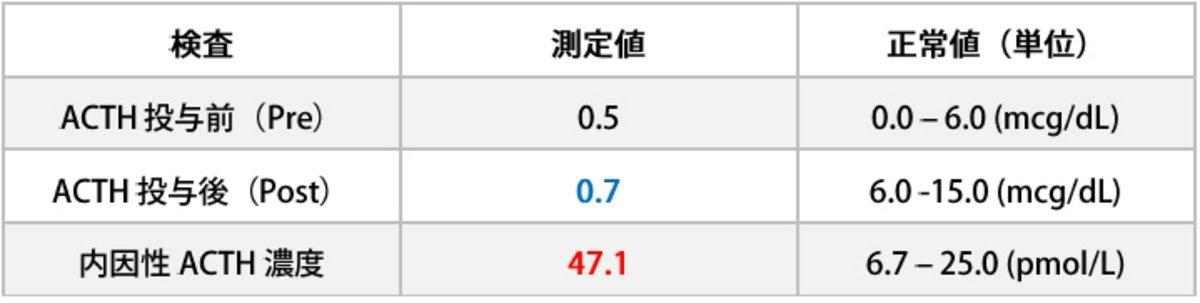
シグナルメント、問診、一般身体検査などの情報からは原因疾患特定に至りませんでしたが、血液検査において低血糖症が見られたことと、ストレス性白血球数変化が見られないことから、非典型的副腎皮質機能低下症(非典型的アジソン病)を疑いました。そこで、レスティングコルチゾール濃度(またはACTH刺激試験におけるACTH投与前血中コルチゾール濃度)を測定したところ0.5 mcg/dL(正常値0 ‒ 6.0 mcg/dL)でした。この結果から副腎皮質機能低下症である可能性が高まったので、確定診断を得る為にACTH刺激試験を行いました(250mcgのACTHを筋肉内注射、1時間後の血中コルチゾール濃度を測定)。
ACTH投与後コルチゾールは0.7 mcg/dLであったことから、副腎皮質機能低下症が診断されました。また下垂体機能不全による続発性(二次性)非典型的副腎皮質機能低下症の可能性を除外する為に、内因性ACTHを測定したところ、結果が47.1 pmol/L(正常値:6.7-25.0)であったことから続発性非典型的副腎皮質機能低下症の可能性は除外されました(表3)。
表3:ACTH刺激検査と内因性ACTH濃度測定結果
ACTH刺激検査結果により副腎皮質機能低下症が診断されたことから、ステロイド投与(デキサメサゾン0.1 mg/kgを毎24時間静脈投与)を開始しました。輸液量は、投与開始後6時間で脱水症状が改善したことから、15mL/hr (2.5%加糖)に減量しました。その後、一般身体検査と血糖値測定を6時間毎に実施し、輸液量を24時間かけて減量していきました。
来院48時間後には状態が著しく改善し、自力で飲水・食餌ができるようなったので、ステロイドをプレドニゾン0.25 mg/kg 毎12時間経口投与に変更しました。入院3日目に退院し、自宅でステロイド投与を継続しました。
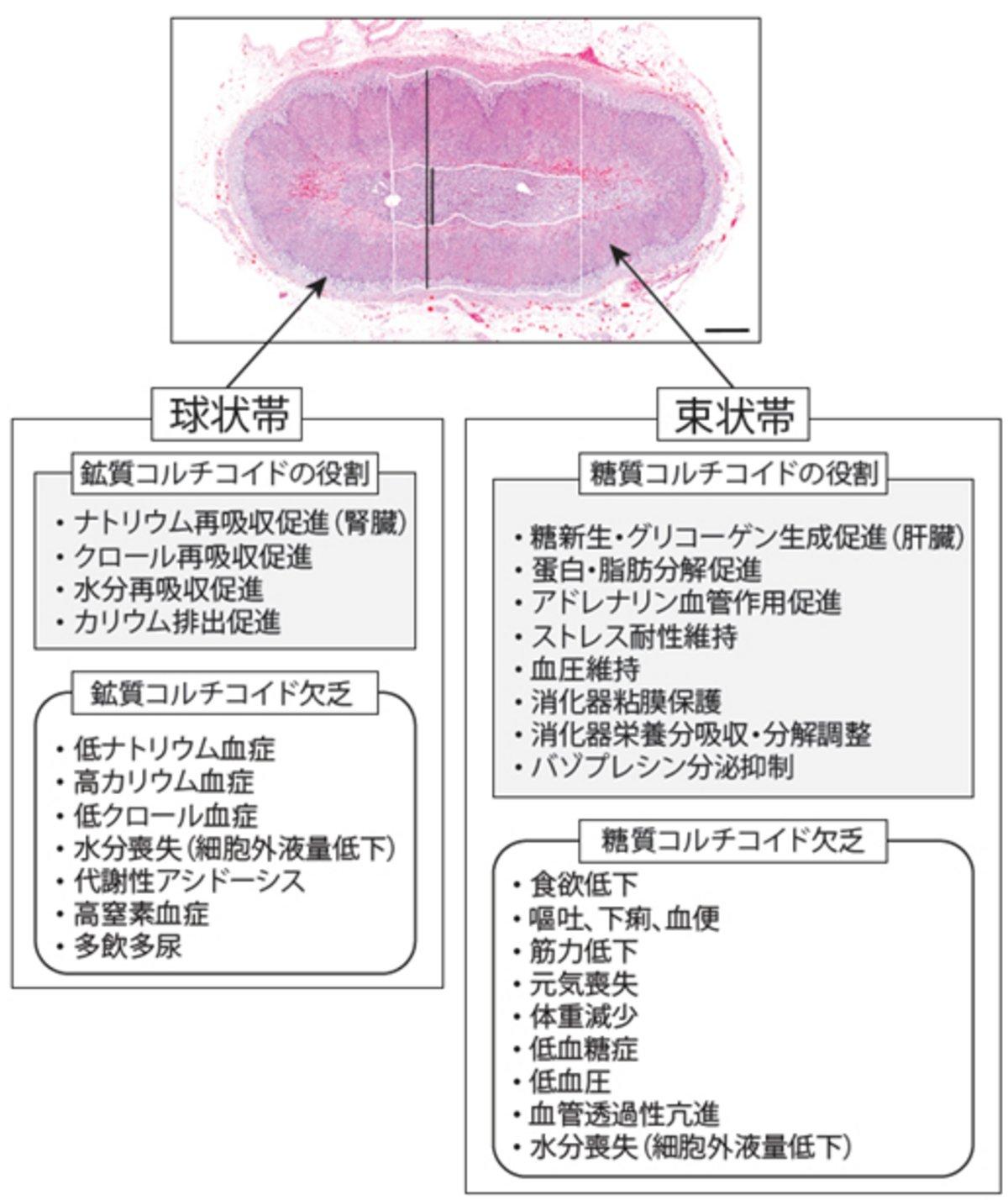
今回紹介した非典型的副腎皮質機能低下症(糖質コルチコイド欠乏)は、典型的副腎皮質機能低下症(糖質と鉱質コルチコイド欠乏)に比べると遭遇する機会は多くはありません。しかし鉱質コルチコイド欠乏によって起こる血液検査上の変化(血中ナトリウム濃度低下とカリウム濃度上昇)が見られず、問診や一般身体検査からは特異的な異常が発見できないことから診断が難しい疾患の一つにあげられます。したがって、本症例のように原因がはっきりとしない元気食欲低下や下痢を呈する動物においては、問診・一般身体検査の時点で、非典型的副腎皮質機能低下症を鑑別診断に加えておくことが必要です(図1)。
図1:鉱質コルチコイドと糖質コルチコイドの役割と欠乏時に見られる主な症状。写真は正常な副腎皮質組織断面図。写真内の外側白線と長黒線は分泌領域、内側白線と短黒線は髄質部を指している。(副腎皮質組織断面図は、Frank CB, et al. Correlation ofinflammation with adrenocortical atrophy in canineadrenalitis. J Comp Pathol. 2013;149:268から抜粋)
非典型的副腎皮質機能低下症を呈する動物は、本症例でも見られたように低血糖症や低コレステロール血症を呈する場合があります。そしてCBC検査では、ストレス性白血球数変化(リンパ球減少、好中球増加、好酸球減少、単球増加)が見られないことが最も重要な特徴の一つとしてあげられます。このように血液検査結果を精査する場合は、異常値はもちろんのこと、正常値も場合によっては異常であり得ることから十分な注意を払う必要があります。
本症例では、一般身体検査において意識混濁が認められたにも関わらず、灌流指標に問題はなく、また意識障害以外の神経疾患が認められませんでした。このような場合には、低血糖症、電解質異常(血中ナトリウム、カリウム濃度異常など)、臓器障害(腎不全、肝不全など)、薬物中毒による意識混濁を疑う必要があります。そしてこれらの疾患は迅速な診断と治療を必要とすることから、POCTによってその場で検査結果を得ることが非常に重要になります。今回紹介した症例においても血糖値、CBC、血液化学検査結果をリアルタイムに得ることができたからこそ、迅速な治療と診断に繋げることができました。
非典型的副腎皮質機能低下症に対する主な治療はステロイド投与です。通常は救急科に来院した患者で経口投与が不可能な動物にはデキサメサゾン(0.1 mg/kg/day)を静脈投与します。そして、状態が改善し経口投与が可能になれば、プレドニゾンを0.20-0.5 mg/kg/dayの用量で投与開始(高用量から開始)します。長期管理にはプレドニゾンの継続投与が必要になりますが、投与量は非典型的副腎皮質機能低下症の症状有無と動物にかかるストレス量によって随時調整をしていく必要があります。また非典型的副腎皮質機能低下症を呈する動物の多くが、将来的に鉱質コルチコイド欠乏を続発し、典型的副腎皮質機能低下症に移行することが多いことから、定期的に血中カリウム濃度とナトリウム濃度を測定することが勧められます。
本症例で見られたように、血糖値、CBC、血液化学検査結果をPOCTとして臨床現場でリアルタイムに得ることができることは、救急医療現場においては非常に重要です。そして、このような検査結果を精査する場合は、異常値だけではなく、本症例の白血球数のように、正常値も場合によっては異常であることから注意を払うことを忘れてはいけません。
引用文献
Baumstark ME, Sieber‐Ruckstuhl NS, Müller C, Wenger M, Boretti FS,Reusch CE. Evaluation of aldosterone concentrations in dogs withhypoadrenocorticism. Journal of Veterinary Internal Medicine. 2014 Jan1;28(1):154-9
Frank CB, Valentin SY, Scott-Moncrieff JCR, Miller MA. Correlation of inflammation with adrenocortical atrophy in canine adrenalitis. Journal of Comparative Pathology. 2013; 149:268-279
Lennon EM, Boyle TE, Hutchins RG, Friedenthal A, Correa MT, BissettSA, Moses LS, Papich MG, Birkenheuer AJ. Use of basal serum orplasma cortisol concentrations to rule out a diagnosis of hypoadrenocorticismin dogs: 123 cases (2000–2005). Journal of the AmericanVeterinary Medical Association. 2007 Aug 1;231(3):413-6
Lifton SJ, King LG, Zerbe CA. Glucocorticoid deficient hypoadrenocorticism in dogs: 18 cases (1986-1995). Journal of the American Veterinary Medical Association. 1996 Dec;209(12):2076-81
Peterson ME, Kintzer PP, Kass PH. Pretreatment clinical and laboratory findings in dogs with hypoadrenocorticism. J Am Vet Med Assoc.1996;208:85-91
Scott-Moncrieff JC. Hypoadrenocorticism. In: Feldman EC and Nelson RW eds. Canine and Feline Endocrinology. 4th ed. Elsevier. St Louise MO. 2014: 485-520
Thompson AL, Scott-Moncrieff JC, Anderson JD. Comparison of classic hypoadrenocorticism with glucocorticoid-deficient hypoadrenocorticism in dogs: 46 cases (1985–2005). Journal of the American Veterinary Medical Association. 2007 Apr 15;230(8):1190-4
2017年3月掲載
※内容は掲載時点の知見であり、最新情報とは異なる場合もございます。
| 施設名 | カリフォルニア大学デービス校獣医大学 Department of Medicine and Epidemiology 大学院生 獣医大学付属病院救急集中治療科スタッフ獣医師 米国公認獣医師、米国公認獣医救急集中治療専門医 上田 悠 |
|---|---|
| 住所 | 1 Garrod Dr. Davis, CA 95616 |
| 診療動物 | イヌ、ネコ |
地図