イオン強度調整剤(ISA:Ionic Strength Adjustor)を用いて校正および測定を実施することで、正確なイオン濃度が測定できます。
ここでは、イオンの濃度と活量の関係、およびイオン強度調整剤を加える理由について説明します。
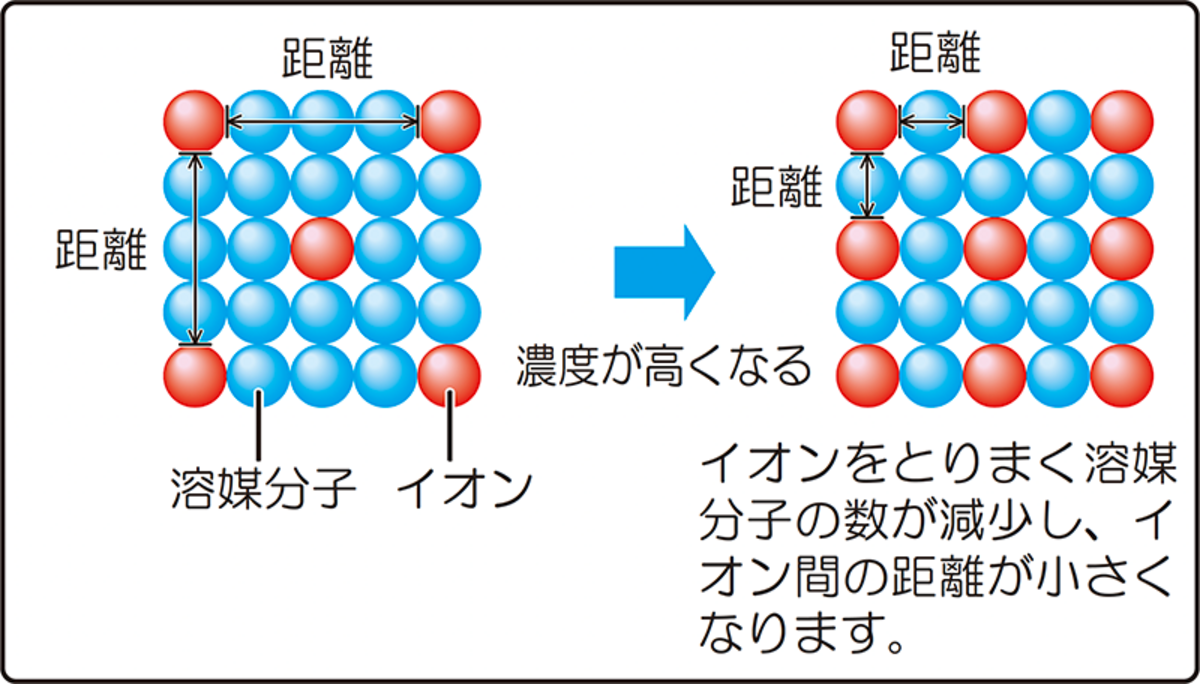
イオン濃度による溶液の状態の違い
イオン強度調整剤(ISA:Ionic Strength Adjustor)を用いて校正および測定を実施することで、正確なイオン濃度が測定できます。
ここでは、イオンの濃度と活量の関係、およびイオン強度調整剤を加える理由について説明します。
イオン濃度による溶液の状態の違い
イオン選択性電極の応答膜は、サンプル液中に特定のイオンが存在すると、そのイオンの濃度に相応した電位を発生します。発生した電位は、比較電極を基準とした電位差としてイオンメータやイオン測定機能を持つ計器で測定されます。測定電位差とサンプル液中の測定対象イオン濃度の対数の間には比例関係が存在し、ネルンストの式で表されます。この式に従えば、標準液で校正を行い、電位勾配を決めておくと、サンプル液のイオン選択性電極の電位差E を測定することで、測定対象イオンの濃度を求めることができます。
ところが、イオンの濃度が高くなるとイオンは自由度を失い、応答膜まで到達できず、「電位測定の応答に寄与できないイオン」が発生します。
そこで、「溶液中で実際に電位測定の応答に寄与することができるイオン量」を実効的な濃度で示す必要があります。この「実効的な濃度」を活量と呼びます。
活量は、溶液中のイオンの濃度を「活量係数」と呼ばれる係数によって補正したもので、これらの間には下記の関係式が成り立ちます。
活量(a)=活量係数(γ)・イオン濃度(C)
表4 はイオンの濃度と活量係数の関係を表しています。
この表より、イオンの濃度が10-3 mol/L より低いと活量係数は1 に近い値となり、10-3 mol/L より高くなるにつれ、活量係数が1 よりも低くなることがわかります。
活量係数が1 よりも低くなると(活量<イオン濃度)、電位測定に誤差を生じます。この誤差を減らすために使用するのがイオン強度調整剤です。
一般的にイオン強度調整剤は、測定対象イオンと反応せず、測定電位に影響を与えないものを選びます。
イオン強度調整剤を添加することで、イオン強度を一定に保ち、サンプル液および標準液の活量係数を同程度に合わせることができるため、測定時の誤差を低減できます。
(例)1価のイオン濃度における活量係数
| イオン濃度(C) mol/L | 活量係数(γ) |
|---|---|
| 1×10-5 | 0.998 |
| 1×10-4 | 0.988 |
| 1×10-3 | 0.961 |
| 1×10-2 | 0.901 |
| 1×10-1 | 0.751 |