
Adam M. GILMORE
HORIBA Jobin Yvon Inc.
濱上 郁子 Ikuko HAMAGAMI
株式会社 堀場製作所
Readout No.33 August 2007
良質な水資源の確保は,人類の豊かな生活を持続的に支える上で不可欠であり,水質の保全・改善はグローバルな環境課題となっている。水中における様々な生物地球化学的過程に影響をおよぼす溶存有機物(DOM)の水環境中での働きや,起源,動態を正しく理解するためには,その質や量を明らかにする必要がある。DOMに含まれる成分のうち,紫外可視領域の光を吸収する成分は,蛍光性溶存有機物Chromophoric DOM(CDOM)と呼ばれている。有機物または人工化合物から由来するCDOMの光学的特性を用いた簡易分析手法して3次元蛍光分析がある。
本稿では,CDOMを評価するため,HORIBA Jobin Yvon社が新製品として発売した3次元蛍光測定装置「Aqualog(アクアログ)」とそのデータ解析について紹介する。まず,CDOMの3次元蛍光スペクトルと同時に紫外可視吸収スペクトルも測定できるAqualogのハードウェアの特徴について説明する。さらに3次元蛍光スペクトル測定における装置間のデータ比較を可能とするため,分光器,検出器,光路特性等の分析装置に特有なパラメータでの補正や,高濃度の吸収成分による蛍光の再吸収(インナーフィルター効果)の補正について説明する。蛍光分析を用いた水質評価手法がより一般的に認知され,3次元蛍光法(Excitation Emission Matrixs;EEM)による分析が,将来水質の国際標準評価法として認められることを希望する。
近年,海洋,河川,湖沼で環境水中の溶存有機炭素Dissolved Organic Carbon(DOC)濃度が増加する傾向が認められ,気温の上昇に伴う泥炭分解速度,水性生物活性,溶存有機物(DOM)の溶解度の増加,さらには年降水量の変化や気候変化が影響しているのではないかと考えられている。
有機物または人工化合物から由来する水中の溶存有機物(CDOM)の光学的特性を用いた簡易な分析手法して,3次元蛍光分析(EEM)を用いた手法が用いられている[1]。
紫外可視域吸収スペクトルと異なり,蛍光スペクトルはいくつかの発光ピークを示すため,DOMの起源や組成,続成作用に関する情報をより多く得ることができる利点がある。また蛍光スペクトルを測定する用途に特化した,この蛍光分光装置は比較的安価で,誰もが簡単に使えて,かつ他の分析装置のような煩雑な前処理等を必要としない(濾過程度の簡便な前処理のみを行えばよい)という利点もある。
蛍光性を有する自然成分としては,植物由来のフミン酸やフルボ酸,動物由来のタンパク質や芳香族アミノ酸成分があり,さらに人工化合物としては,石油系成分,化学肥料,農薬,除草剤,薬品成分,さらに最近では毒性が懸念されるナノマテリアル等がある。
これまでの代表的な河川および湖沼の水質評価の指標として,溶存酸素(DO),全有機炭素(TOC),吸光度,透明度,酸素要求量(河川の汚濁指標として生物化学的酸素要求量Biochemical Oxygen Demand(BOD),海域や湖沼の汚濁指標として化学的酸素要求量Chemical Oxygen Demand(COD)等が使用されている。CDOMも最近,水質評価の指標の一つとして注目されている。
CDOMは直接的に酸素要求量に関連する水質評価の指標とされるが,環境水中ではCDOMが紫外光の暴露により光分解がおこり酸素が消費されるからである。
水中のCDOMの含有量を調べる光学的な手法には,紫外可視吸収スペクトルの測定と蛍光特性を調べる3次元蛍光スペクトル測定がある[1,2,15]。
紫外可視吸収スペクトルは,CDOMが様々な成分の混合物であり,またCDOMの主要な構成要素である腐植成分は電子伝達系が発達しているため,通常特定な ピークを示さず,短波長になるに従って指数関数的に単調に増加する。したがって,Y軸を対数表記した場合には切片と傾きをもって特徴づけられず一次関数に なる。
一方,3次元蛍光スペクトルは,紫外可視吸収スペクトルとは異なり,検出されるピーク位置の違いやスペクトル形状の特徴的な違い等から,腐 植物質をはじめとした有機物や人工化合物に関する情報をより多く得ることができるというメリットがある。しかしこの分析においても,様々な成分からの発光 ピークが重なりあって表示されていることが多く,単純にピークをピッキングするだけではEEMの情報を十分に活用するには難しい。
PLS(Partial Least Squares),PCA(Principal Component Analysis),PARAFAC(Parallel Factor Analysis)は,多変量解析法として知られているが,特にPARAFACはCDOMの重なりあった蛍光ピークを同じ挙動を示す成分ピークに分離する ことができる手法として採用されている。PARAFACは各成分スペクトルを個々に分離し,それぞれのスペクトルに現れたピーク位置を正確にとらえ,その 成分スペクトルのピーク位置を正確に表示できるため,その後の定量的な解析につなげることができる。このことから最近ではPARAFACモデルを 用いた多変量解析をEEM法によるCDOM分析に用いるケースが増えてきている[1-6]。
PARAFACモデルを使うEEM法によるCDOM分析における課題は,いかにして高精度なスペクトルを再現性よく得られるかということにある[1,2,6,7,9]。このためには以下のような補正を行うことが必須となる。
サンプルによる励起光の吸収が生じ(第1インナーフィルター効果),さらにCDOM成分の吸収帯と蛍光帯の領域がオーバーラップしている場合にはサンプルから発光した蛍光の再吸収が生じる(第2インナーフィルター効果)。実際の蛍光強度は,インナーフィルター効果により,理論値よりも低くなるため,これを補正することはスペクトル解析において重要である。CDOM分析において,成分同定はあくまでも研究者らが作成したスペクトルのライブラリーに基づいて行う。実験室間でデータの比較を行うためには,同定のためのトレーサブルで再現性の高いスペクトルが必要となるが,CDOMの3次元蛍光データを測定した装置や測定条件は論文ごとに異なる点が危惧される[8]。
高感度を有するAqualog(アクアログ)は,水中のCDOMのEEM分析用に開発改良された蛍光測定装置である。
Aqualogは,CCD検出器を搭載しているため,PMT検出器を搭載した従来の蛍光分光光度計よりも高速で3次元蛍光スペクルデータを取得することができる。Aqualogは,スペクトルの精度をあげるために色収差のないミラーを使った光学系と,低迷光タイプのダブル分光器を励起側に採用した。スペクトル補正用蛍光標準物質にはNational Institute of Standards(NIST)製の固形試料を使用している。紫外光を吸収するCDOMを励起できるように紫外域が強化されたランプ光源を搭載した。
Aqualogの装置構成図をFigure 1に示す。
キセノンランプ光源(1)の後段には励起用ダブル分光器(2)が搭載され純度の高い励起光がサンプル室に誘導される。紫外光の吸収によりCDOMが分解されることを防ぐため,励起光は,エネルギーの低い可視域から,よりエネルギーの高い紫外域へ波長をスキャンさせる。励起光はサンプル室(3)の前段に配置されたリファレンス検出器(4a)によって,その強度がモニターされる。サンプル室後段(励起光に対して90度方向)には蛍光測定用にCCDアレイ検出器と一体になったスペクトログラフ(4c)を配置することでEEM分析のデータ取得のスピードを大幅にアップした。
CDOMの研究においては多数サンプルのEEM分析データを測定することが求めらるため測定スピードは重要な装置特性である。装置の制御系は装置ベース部に配置されている(5)。さらに,サンプル室の後段(励起光に進行方向に配置)にはサンプルの透過光を測定するために固体素子検出器(4b)が搭載され,これにより試料の紫外可視吸収スペクトルと3次元蛍光スペクトルの測定を同時に行うことができる。得られた紫外可視吸収スペクトルを用いることで3次元蛍光スペクトルデータにおけるインナーフィルター効果の影響をソフトウェア上で簡単に補正することができる。
Aqualogは,卓上型の小型分析システムにしたことで研究室に導入しやすい価格とサイズを実現しており,また船上等での分析にも使える堅牢性や可搬性も兼ね備えた装置となっている。
Figure 1 CDOMのEEM分析のための卓上型蛍光測定装置「Aqualog」の装置構成図
CDOMに対する3次元蛍光測定(Figure 2A)では,セルにいれた水サンプルを240-500 nmの励起波長で励起しながら250-600 nmの蛍光スペクトルを連続的計測する。励起側および蛍光側の分光器のスリット幅はバンドパス5nmに固定されている。励起光は励起源の波長に依存した強度を有するため,蛍光検出器(S)で検出する蛍光シグナルは,各励起波長ごとにリファレンス検出器(R)でモニターした励起源の強度で割り算しなくてならない。加えてリファレンス検出器(R)と蛍光検出器(S)のシグナルは装置ごとのスペクトル感度に対する補正が必要である。
ここで言うスペクトル感度の補正とは,リファレンス検出器(R)のシグナルから暗電流を引き算したものに励起補正スペクトル用の補正ファクター(Xcorrect)を掛け算すること,同様に蛍光検出器(S)のシグナルから暗電流を引き算したものに蛍光補正スペクトル補正ファクター(Mcorrect)を掛け算することである。結果としてAqualogでは最終的にEEMシグナルはSc/Rcとしてソフトウェア上に取得される。ここでSc=(S-dark)×Mcorrect,Rc=(R-dark)×Xcorrectを示す。
3次元蛍光データ測定と同時に,CDOMの紫外可視吸収スペクトルは固体素子検出器(A)によって測定され,I=Ac/Rcとしてソフトウェア上に取得される。ここでAc=(A-dark),Rc=(R-dark)×Xcorrectを示す。サンプルの吸収スペクトルを測定するためにI0=ブランク/リフェレンスサンプルの(Ac/Rc)を測定してAbs=Log(I0/I)として計算する。慣例的に標準サンプルやブランクとして,通常は超純粋(≧18.2 MΩ,全炭素量TOC<2ppb)が用いられる。ブランクはスペクトル分析において3次元蛍光データを補正する際や処理する際に必要となる。
Figure 2 An excitation-emission map of the Pony Lake Fulvic Acid standard sample from the International Humic Substance Society(A). Panel B shows the absorbance spectrum of the sample shown in(A)measured under the same bandpass and integration time conditions
PARAFACモデルを用いた3次元蛍光分析における課題は,高精度なスペクトルが再現性良く得られるかということにある。このため以下のようなスペクトル補正を行うことが必須となる。(Figure 3)
Figure 6 A comparison of the concentration dependence of the absorbance spectra(A and B)and the excitation spectra of the Pony Lake Fulvic Acid sample before(C and D)and after(E and F)inner-filter correction.
Figure 4Aは超純水(ブランクとして)のEEMマップを示す。ここには励起光の1次光および2次光のレイリー散乱によるラインが読み取れる。これは分光器のグレーティング反応によるものである。またFigure 4Aには水のラマン光散乱によるラインも読み取れる。水のラマン光散乱はレイリー散乱に対して常に3,328㎝-1エネルギーシフトした波長に現れる。CDOM成分のライブラリーは人為的なレイリー散乱や水のラマン光散乱のスペクトルは取り除かれたスペクトルとなっている。このためEEMデータはこのような不要な散乱光ピークを取り除いておく必要がある。
Figure 4BはCDOMサンプルから得られた未補正のE E M生データを示す。これは国際腐植物学会(IHSS)より取り寄せたポニー湖(Pony Lake)のフルボ酸(PLFA)の標準試料の分画である。ここではCDOM成分と一緒にレイリー光散乱や水のラマン光散乱のラインも等高線マップ上に表示されている。Aqualogのソフトウェアを用いればこのようなレイリー散乱光を簡単に削除することができる。
Figure 4CはFigure 4Bの未補正のEEM生データからFigure 4Aのブランクを差し引いた結果を示している。
さらにFigure 4DはFigure 4Cのデータからさらに1次光,2次光のレイリー散乱を消し込んだアルゴリズムの結果を示す。硫酸キニーネ(QSU)の蛍光スペクトルデータを元にしてCDOMのEEMデータをノーマライズする[1,6,12]。AqualogのソフトウェアのEEMプロセシングを使えば水のラマン光と硫酸キニーネ(QSU)によるノーマライゼイションに簡単に対応することができる。レイリー散乱や水ラマン光散乱の補正に加えて,サンプルとブランクから同時に測定した紫外可視吸収スペクトルを使ってインナーフィルター効果によるEEM分析データの補正を行う。Aqualogのインナーフィルター効果のアルゴリズムを使って一次および二次のインナーフィルター効果を補正するためには励起スペクトルと蛍光スペクトルの両方がオーバーラップする領域の吸収スペクトルを測定することが必要となる。標準的な1㎝光路長のセルで測定する場合,CDOMによる蛍光の再吸収インナーフィルター効果(IFE)を以下の式により補正する[11]。
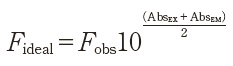
ここで,FidealはIFEがない理想的な(補正後の)蛍光強度,Fobsは測定した蛍光強度,AbsExとAbsEmは励起波長における試料の吸光度,AbsEmは蛍光波長における試料の吸光度を示す。装置間の比較を可能するために,分光器や検出器,光路特性等,装置に特有なパラメータを補正する。文献に書かれているアルゴリズムでは,光学上幾何学的なパラメータとしてセルの光路長,ビーム幅やスリット幅,励起光および蛍光ビーム光路に関連するセル配置や取換え等の装置固有のパラメータ等も説明される[10-13]。
Figure 4 The fundamental instrument correction operations for processing an excitation emission map including blank subtraction and Rayleigh line nullification.
Figure 5Aと5Bは,254 nmのAbs=0.8の高濃度PLFAサンプルのEEMデータを示し,Figure 5Cと5Dは,254 nmのAbs=0.2の低濃度PLFAサンプルのEEMデータを示す。通常,光路長1 m,DOC濃度1 mg/Lあたりの254 nmにおける吸光度が用いられ,これはSUVA(もしくはSUVA254;Specific UV Absorption)と呼ばれる。254 nmでの吸光度はCDOM濃度を評価するための業界スタンダードとなっている[8,15]。
左側の上下のデータ(Figure 5Aと5C)は共に未補正のEEM生データ(Fobs)であり,右側の上下のデータ(Figure 5Bと5D)は共に補正済みのEEMデータ(Fideal)である。
Figure 5Aに示した未補正の高濃度PLFAサンプルのEEMデータでは励起波長(横軸)300 nm以上に(300 nm以下に比べて)顕著な発光ピークが表れている。このサンプルでは300 nm以下の紫外領域でインナーフィルター効果の影響が強いことがわかる。この波長領域では励起スペクトルと蛍光スペクトルがオーバーラップしている。高濃度PLFAサンプルのEEMデータにIFE補正を行ったものでは(Figure 5B),低濃度PLFAサンプルのEEMデータをほぼ同じようなパターンを示す。低濃度PLFAサンプルでは,Figure 5C(IFE未補正)とFigure 5D(IFE補正済)のデータを見比べてみるとわかるように,蛍光のパターンにほとんど差がないことがわかる。このようにCDOM濃度が高いサンプルについてはIFEの影響が大きいためIFEの補正を行うことが望ましい。
Figure 5 A comparison of the influence of the inner-filter correction algorithm on excitationemission maps of concentrated(top row)and dilute(bottom row)samples of the Pony Lake Fulvic Acid standard sample.
Figure 6ではよりIFE補正の影響を詳しく示すために,可視紫外吸収スペクトルと,低濃度PLFAのEEMデータの励起スペクトルを比較している。
Figure 6Aは希釈の度合ごとのPLFAサンプルの紫外可視吸収スペクトルを示している。吸収スペクトルは特定のピークを示すことなく,紫外から可視領域において長波長になるに従い単調に減少している。
Figure 6BにはFigure 6Aに示した希釈の度合(横軸)と吸収スペクトルの254 nmでの吸光度(縦軸)のプロットを示す。
Figure 6BのデータからAbs=0.8付近の吸収のピークに至るまでサンプル濃度と吸光度には高い相関があることがわかる。
Figure 6Cでは励起スペクトルのFob(s 励起強度)をみると400 nmより短波長域で励起強度が大きく減っていることがわかる。
Figure 6Dでは,インナーフィルター効果が高まる,吸光度が0.2を超えるエリアでは,254 nmでの吸光度(縦軸)と励起強度(横軸)との間に相関が認められないことがわかる。
しかしながらFigure 6Eに示すように,インナーフィルター効果(IFE)の補正を行った励起スペクトルでは短波長域の強度が復活して,Figure 6Aの吸収スペクトルと同様なプロファイルが得られた。254 nmの励起強度(縦軸)と254 nmの吸収強度(横軸)にも高い相関が確認され,特に高濃度CDOMサンプルの分析におけるIFEの補正の重要性が確認できる。
Figure 6 A comparison of the concentration dependence of the absorbance spectra(A and B)and the excitation spectra of the Pony Lake Fulvic Acid sample before(C and D)and after(E and F)inner-filter correction.
レイリー散乱のマスキング,水ラマン光散乱の除去,水のラマンや硫酸キニーネによるノーマライゼーション,インナーフィルター効果の補正や装置固有のスペクトル関する一連の補正は,AqualogのソフトウェアのEEMプロセシングツールによって簡単に実行することができる。スペクトルの補正とEEMプロセシングの目的は,標準物質のライブラリーを基にしてCDOM成分をより簡便に同定や定量分析を行うことにある。
我々はCDOM分析においてPARAFACと呼ばれる多変量解析に注目し,その解析法を採用している[1,3-5]。Aqualogのソフトウェアを使えば,CDOM分析用に開発されたEigenvector Research社のPARAFACを使ったデータプロセシングのためのEVSoloソフトに直接アクセスすることができる(MatLabソフトにもアクセスすることができる[4])。
PARAFACモデルの利点はEEMデータを評価する能力を持ちながら,統計的な有意性を高めるために多数のEEMデータ(しばし
ば数百ものデータ)を同時に処理できる点にある[3-5]。
フミン酸やフルボ酸,トリプトファン(タンパク質),チロシン様態(フェノール性αアミノ酸),キノン化合物,多環式芳香族炭化水素等の成分を特定することができる。またCDOMが微生物由来のものなのか,海洋性のもの,または陸生のものから由来するのか等も特定することができる。水のリサイクル処理工程,排水,河川,海洋,河口潮流におけるCDOM成分を診断する際には化学的,物理的な水質指標としてPARAFAC解析が使われはじめている[6]。
様々な水質分析アプリケーションに対するスタンダードなモデリングのテクニックとしてPARAFACによる解析を以下のように提案する[1,14]。
CDOMを3次元蛍光分析で評価するアプリケーションにおいて,EEMデータを装置間,研究室間で比較できるように蛍光分光装置のキャリブレーションやスペクトル補正に関して鍵となる論文や,国際標準化のための書籍が出版されている。NIST研究者らによる最近の出版物では,特にEEM分析データの補正の重要性が強調され,蛍光のキャリブレーションや補正のため最近リリースされたASTM標準ガイド(E2719)[9]に関してや,CDOMのEEM分析,装置,IFE補正に関して記載されている[2],さらに一連の標準物質を生成し評価することにおいて使用される高精度の蛍光分光測定装置のバリデーションに関しても記載されている[7]。
さらに最近の論文では,CDOMIHSS標準サンプルに対する主な国際的な研究室間におけるデータ比較結果を概説している。この研究は,研究者とUnited State Geological Survery(USGS)により主導され,アメリカの地球物理学学会[8]が主催した2008年のチャップマンコンファレンスの成果として注目された。CDOMの潜在的なアプリケーション展開として,調査報告書では水のリサイクルの全過程での水質のモニタリングに採用できないか検討され[14],さらに別の報告書では環境水や排水の分析の指標に採用できないか検討されている[1]。
CDOMの蛍光分析で評価することや3次元蛍光法の活用は学術分野および政府機関での水分析の研究や,地方自治体や工業での水質モニタリングにおいて重要な役割を果たすことが期待される。
HORIBAグループのHORIBA Jobin Yvon社では,EEM分析を使ったCDOM評価に特化した蛍光測定装置と多変量解析PRAFACソフトウェアを組み合せた提案を行うことでこれらの市場ニーズにいち早く対応しようとしている。今後は装置やソフトウェアをより使いやすいものにしていきながら,CDOMの標準化や規制を推進していくことで水質分析におけるEEM分析の将来性を高めていきたい。人類にとってかけがえのない資源である水,その水質におよぼすCDOMの影響を理解するために分析を通じた貢献が期待されている。
Readout No.41 September 2013
[ 1 ] Hudson, et al., River. Res. Applic., 23, 631(2007)
[ 2 ] Holbrook, et al., Appl. Spectroscopy, 60, 7, 791(2006)
[ 3 ] Stedmon, C. A., S. Markager and R. Bro., Mar. Chem., 82, 239(2003)
[ 4 ] Stedmon, C. A., S. Markager and R. Bro., Limnol. Oceanogr. :
Methods, 6, 572(2008)
[ 5 ] Cory, R. M., and D. M. McKnight, Sci.Technol., 39, 8142(2005)
[ 6 ] Cory, et al., Limnol. Oceanogr.: Methods, 8, 67(2010)
[ 7 ] DeRose, et al., Rev. Sci. Instr., 78, 033107(2007)
[ 8 ] Murphy, et al., Environ. Sci. Technol.(, in press)(, 2010)
[ 9 ] Paul C. DeRose and Ute Resch-Genger,, Anal. Chem., 82, 2129 (2010)
[10] Qun Gu and Jonathan E. Kenny, Anal. Chem., 81, 420(2009)
[11] Lakowicz, J. R., Principles of Fluorescence Spectroscopy, 3rd ed. Springer Science and Business Media, LLC: New York(, 2006)
[12] Tobias Larsson, Margareta Wedborg, and David Turner, Anal. Chim. Acta, 583, 357(2007)
[13] B. C. MacDonald, S. J. Lvin, and H. Patterson, Anal. Chim. Acta, 338, 155(1997)
[14] Henderson, et al., A review. Water Research, 43, 863(2010)
[15] 眞家永光, 水環境中の溶存有機物の光学的特性を用いた質のモニタリング 農業農村工学会大会講演会講演要旨集:52(- 2009)
三次元蛍光測定装置
HORIBAでは、技術情報誌としてReadoutを発行しています。誌名“Readout(リード・アウト)”には、HORIBAが創造・育成した製品や技術に関する情報を広く世にお知らせし、読み取って頂きたいという願いが込められています。